Carder
Professional
- Messages
- 2,619
- Reaction score
- 1,882
- Points
- 113

Атомы находятся в вашем теле, в кресле, в котором вы сидите, в вашем столе и даже в воздухе.
Было сказано, что в 20 веке человек использовал силу атома. Мы делали атомные бомбы и производили электричество с помощью ядерной энергии. Мы даже разбиваем атом на более мелкие части, называемые субатомными частицами.
Но что такое атом? Из чего это сделано? На что это похоже? В поисках структуры атома соединились многие области химии и физики, что, возможно, стало одним из величайших достижений современной науки. В этой статье мы проследим увлекательную историю о том, как открытия в различных областях науки привели к нашему современному взгляду. атома. Мы рассмотрим последствия знания структуры атома и то, как эта структура приведет к появлению новых технологий.
Что такое атом? Наследие древних времен в XIX веке
Современные представления об атоме пришли из многих областей химии и физики. Идея атома пришла из древнегреческой науки / философии и из результатов химии 18-19 веков:- концепция атома
- измерения атомной массы
- повторяющиеся или периодические отношения между элементами
Концепция атома
От древних греков до наших дней мы размышляли, из чего состоит обычная материя. Чтобы понять проблему, вот простая демонстрация из книги Карла Х. Снайдера «Необычная химия обычных вещей, 3-е издание»:- Возьмите стопку скрепок (все одного размера и цвета).
- Разделите стопку на две равные стопки.
- Разделите каждую из меньших стопок на две равные стопки.
- Повторяйте шаг 3, пока не дойдете до стопки, содержащей только одну скрепку. Эта скрепка по-прежнему выполняет функцию скрепки (т. Е. Скрепляет отдельные листы бумаги).
- Теперь возьмите ножницы и разрежьте скрепку пополам. Может ли половина скрепки выполнять ту же работу, что и одиночная скрепка?
Идея атома была впервые изобретена Демокритом в 530 году до нашей эры. В 1808 году английский школьный учитель и ученый по имени Джон Дальтон предложил современную атомную теорию. Современная атомная теория просто утверждает следующее:
- Каждый элемент состоит из атомов - груды скрепок.
- Все атомы любого элемента одинаковы - все скрепки в стопке одинакового размера и цвета.
- Атомы разных элементов разные (размер, свойства) - как скрепки разного размера и цвета.
- Атомы разных элементов могут объединяться в соединения - вы можете соединять скрепки разных размеров и цветов вместе, чтобы создавать новые структуры.
- В химических реакциях атомы не образуются, не разрушаются или не изменяются - не появляются новые скрепки, скрепки не теряются, и скрепки не меняются с одного размера / цвета на другой.
- В любом соединении количество и виды атомов остаются такими же - общее количество и типы скрепок, с которых вы начинаете, такие же, как и когда вы заканчиваете.
Важные термины
- атом - мельчайший кусочек элемента, сохраняющий свои химические свойства
- соединение - вещество, которое может быть разбито на элементы с помощью химических реакций
- электрон - частица, вращающаяся вокруг ядра атома с отрицательным зарядом (масса = 9,10 х 10-28 грамм)
- элемент - вещество, которое не может быть разрушено химическими реакциями
- ион - электрически заряженный атом (т.е. избыточный положительный или отрицательный заряд)
- молекула - наименьший фрагмент соединения, сохраняющий свои химические свойства (состоит из двух или более атомов)
- нейтрон - частица в ядре атома без заряда (масса = 1,675 x 10-24 грамма)
- ядро - плотное центральное ядро атома (состоящее из протонов и нейтронов)
- протон - частица в ядре атома с положительным зарядом (масса = 1.673 х 10 -24 г)
Сколько весят атомы?
Простейшая модель атома.
Способность взвешивать атомы появилась благодаря наблюдению итальянского химика Амадео Авогадро. Авогадро работал с газами (азот, водород, кислород, хлор) и заметил, что при одинаковых температуре и давлении эти газы соединяются в определенных объемных соотношениях. Например:
- Один литр азота в сочетании с тремя литрами водорода с образованием аммиака (NH 3 ).
- Один литр водорода в сочетании с одним литром хлора для получения хлористого водорода (HCl).
В это время химики знали атомные массы элементов и их химические свойства, и их поразило удивительное явление!
Свойства элементов показывают повторяющийся узор
Когда были открыты атомные массы, русский химик Дмитрий Менделеев писал учебник. В своей книге он начал систематизировать элементы по их свойствам, размещая элементы и их недавно обнаруженные атомные массы на карточках. Он расположил элементы, увеличивая атомную массу, и заметил, что элементы с подобными свойствами появляются через определенные промежутки времени или периоды. Таблица Менделеева имела две проблемы:- В его «таблице Менделеева» были пробелы.
- При группировке по свойствам большинство элементов имели увеличивающуюся атомную массу, но некоторые были не в порядке.
Дальше мы рассмотрим, как мы обнаружили внутреннюю часть атома!
Структура атома: наука начала 20 века
Чтобы узнать структуру атома, мы должны знать следующее:- Какие части атома?
- Как устроены эти части?
- Части атома: химия и электромагнетизм ---> электрон (первая субатомная частица) радиоактивность ---> ядро протон нейтрон
- Как устроен атом - квантовая механика складывает все это воедино : атомные спектры ---> Боровская модель атома волна-частица дуальности ---> Квантовая модель атома
Химия и электромагнетизм: открытие электрона
В конце 19 века химики и физики изучали взаимосвязь между электричеством и материей. Они пропускали электрические токи высокого напряжения через стеклянные трубки, заполненные газом низкого давления (ртуть, неон, ксенон), как неоновые огни. Электрический ток передавался от одного электрода (катода) через газ к другому электроду ( аноду ) пучком, называемым катодными лучами . В 1897 году британский физик Дж. Дж. Томсон провел серию экспериментов со следующими результатами:- Он обнаружил, что если трубка находится в электрическом или магнитном поле, то катодные лучи могут отклоняться или перемещаться (так работает электронно-лучевая трубка (ЭЛТ) на вашем телевизоре).
- Применяя только электрическое поле, только магнитное поле или их комбинацию, Томсон мог измерить отношение электрического заряда к массе катодных лучей.
- Он обнаружил, что отношение заряда к массе катодных лучей было одинаковым, независимо от того, какой материал был внутри трубки или из чего был сделан катод.
- Катодные лучи состояли из крошечных отрицательно заряженных частиц , которые он назвал электронами.
- Эти электроны должны были исходить от внутри атомов газа или металлического электрода.
- Поскольку отношение заряда к массе было одинаковым для любого вещества, электроны были основной частью всех атомов.
- Поскольку отношение заряда к массе электрона было очень высоким, электрон должен быть очень маленьким.
Два других вывода были сделаны из открытия электрона:
- Поскольку электрон был заряжен отрицательно, а атомы электрически нейтральны, где-то в атоме должен быть положительный заряд.
- Поскольку электроны намного меньше атомов, в атоме должны быть другие, более массивные частицы.
Радиоактивность: открытие ядра, протона и нейтрона
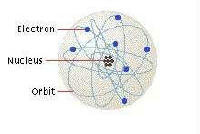
Взгляд Резерфорда на атом.
Примерно в то же время, что и эксперименты Томсона с катодными лучами, физики, такие как Анри Беккерель, Мария Кюри, Пьер Кюри и Эрнест Резерфорд, изучали радиоактивность . Радиоактивность характеризовалась тремя типами испускаемых лучей (подробнее см. Как работает радиоактивность):
- Альфа-частицы - положительно заряженные и массивные. Эрнест Резерфорд показал, что эти частицы были ядром атома гелия.
- Бета-частицы - отрицательно заряженные и легкие (позже выяснилось, что это электроны).
- Гамма-лучи - нейтрально заряженные и без массы (то есть энергии).
- Большинство частиц проходили сквозь фольгу и попадали на экран.
- Одни (0,1%) отклонялись или рассыпались перед (под разными углами) фольгой, другие - за фольгой.
Однако протоны не могли быть единственной частицей в ядре, потому что количество протонов в любом данном элементе (определяемое электрическим зарядом) было меньше веса ядра. Следовательно, должна существовать третья, нейтрально заряженная частица! Это был Джеймс Чедвик , британский физик и сотрудник Резерфорда, который открыл третью субатомную частицу, нейтрон. Чедвик бомбардировал бериллиевую фольгу альфа-частицами и заметил выходящее нейтральное излучение. Это нейтральное излучение могло, в свою очередь, выбивать протоны из ядер других веществ. Чедвик пришел к выводу, что это излучение представляет собой поток нейтрально заряженных частиц с массой примерно такой же, как у протона; нейтрон имеет массу 1,675 х 10 -24 грамма.
Теперь, когда части атома были известны, как они были устроены, чтобы образовать атом? Эксперимент Резерфорда с золотой фольгой показал, что ядро находится в центре атома и что атом в основном представляет собой пустое пространство. Итак, он представил атом как положительно заряженное ядро в центре с отрицательно заряженными электронами, вращающимися вокруг него, как планету с лунами. Хотя у него не было доказательств того, что электроны вращаются вокруг ядра, его модель казалась разумной; однако это представляло проблему. Когда электроны движутся по кругу, они теряют энергию и излучают свет. Потеря энергии замедлит электроны. Как любой спутник, замедляющиеся электроны попадут в ядро. Фактически, было подсчитано, что атом Резерфорда просуществует всего лишь миллиардные доли секунды, прежде чем схлопнется! Чего-то не хватало!
Квантовая механика: соединяем все вместе
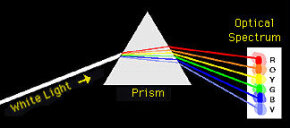
Белый свет, проходящий через призму.
В то же время, когда делались открытия в области радиоактивности, физики и химики изучали, как свет взаимодействует с веществом. Эти исследования положили начало квантовой механике и помогли решить структуру атома.
Квантовая механика проливает свет на атом: модель Бора
Физики и химики изучали природу света, который испускается, когда электрические токи пропускаются через трубки, содержащие газообразные элементы (водород, гелий, неон), и когда элементы (например, натрий, калий, кальций и т. д.) Нагреваются в пламени. Они пропускали свет от этих источников через спектрометр (устройство, содержащее узкую щель и стеклянную призму).
Непрерывный спектр белого света.
Теперь, когда вы пропускаете солнечный свет через призму, вы получаете непрерывный спектр цветов, как радуга. Однако, когда свет от этих различных источников проходил через призму, они обнаружили темный фон с дискретными линиями.

Спектр водорода.

Спектр гелия.
Каждый элемент имеет уникальный спектр, а длина волны каждой линии в спектре имеет определенную энергию (см. Как работает свет, чтобы узнать подробности о взаимосвязи между длиной волны и энергией).
В 1913 году датский физик Нильс Бор соединил открытия Резерфорда с наблюдаемыми спектрами, чтобы создать новую модель атома, совершив настоящий скачок интуиции. Бор предположил, что электроны, вращающиеся вокруг атома, могут существовать только на определенных энергетических уровнях (т. Е. На расстояниях) от ядра, а не на непрерывных уровнях, как можно было бы ожидать из модели Резерфорда. Когда атомы в газовых трубках поглощали энергию электрического тока, электроны становились возбужденными и перепрыгивали с низких энергетических уровней (близких к ядру) на высокие энергетические уровни (дальше от ядра). Возбужденные электроны вернутся на свои исходные уровни и будут излучать энергию в виде света. Поскольку между уровнями энергии были определенные различия, в спектре были видны только световые волны определенной длины (например, линии).

Боровские модели различных атомов.
Главное преимущество модели Бора состояло в том, что она работала. Это объясняло несколько вещей:
Атомные спектры - обсуждалось выше
Периодическое поведение элементов - элементы со схожими свойствами имели схожие атомные спектры.
- Каждая электронная орбита одного и того же размера или энергии ( оболочки ) могла удерживать только определенное количество электронов. Например, первая оболочка может содержать два электрона, вторая - восемь электронов, третья - 18 электронов, четвертая - 32 и так далее, пока не достигнет седьмого.
- Когда одна оболочка была заполнена, электроны были обнаружены на более высоких уровнях.
- Химические свойства были основаны на количестве электронов во внешней оболочке. Элементы с полными внешними оболочками не реагируют. Другие элементы принимают или отдают электроны, чтобы получить полноценную внешнюю оболочку.
Модель Бора была преобладающей до тех пор, пока не были сделаны новые открытия в квантовой механике.
Квантовая механика
Раздел физики, изучающий движение частиц по их волновым свойствам на атомном и субатомном уровне.
Электроны могут вести себя как волны: квантовая модель атома
Хотя модель Бора адекватно объясняла, как работают атомные спектры, физиков и химиков беспокоило несколько проблем:- Почему электроны должны быть ограничены только определенными уровнями энергии?
- Почему электроны не излучают свет все время? Когда электроны меняют направление на своих круговых орбитах (то есть ускоряются), они должны излучать свет.
- Модель Бора могла очень хорошо объяснить спектры атомов с одним электроном на внешней оболочке, но не очень хорошо для атомов с более чем одним электроном на внешней оболочке.
- Почему только два электрона могли поместиться в первой оболочке и почему по восемь электронов в каждой после этого? Что такого особенного в двух и восьми?
В 1924 году французский физик Луи де Бройль предположил, что, как и свет, электроны могут действовать как частицы и волны (подробности см. в теме « Фазовая волновая анимация де Бройля»). Гипотеза Де Бройля вскоре была подтверждена в экспериментах, которые показали, что электронные лучи могут дифрагировать или искривляться, когда они проходят через щель, так же, как и свет. Итак, волны, создаваемые электроном, удерживаемым на своей орбите вокруг ядра, создают стоячую волну определенной длины волны, энергии и частоты (то есть уровней энергии Бора), подобно тому, как гитарная струна создает стоячую волну, когда ее щипают.
Другой вопрос быстро последовал за идеей де Бройля. Если бы электрон двигался как волна, могли бы вы определить точное положение электрона в волне? Немецкий физик Вернер
Гейзенберг ответил отрицательно в том, что он назвал принципом неопределенности:
- Чтобы увидеть электрон на своей орбите, вы должны направить на него свет с длиной волны, которая меньше длины волны электрона.
- Эта небольшая длина волны света обладает высокой энергией.
- Электрон поглотит эту энергию.
- Поглощенная энергия изменит положение электрона.
Имея в виду гипотезу де Бройля и принцип неопределенности Гейзенберга, австрийский физик Эрвин Шредингер в 1926 году вывел набор уравнений или волновых функций для электронов. Согласно Шредингеру, электроны, удерживаемые на своих орбитах, будут создавать стоячие волны, и вы могли бы описать только вероятность того, где мог бы находиться электрон. Распределения этих вероятностей сформированные области пространства вокруг ядра были названы орбиталями. Орбитали можно описать как облака электронной плотности (см. Атомные и молекулярные орбитали для просмотра различных орбиталей). Самая плотная область облака - это место, где у вас наибольшая вероятность найти электрон, а наименее плотная область - это место, где у вас наименьшая вероятность найти электрон.
Волновые функции

Квантовая модель атома натрия.
Волновую функцию каждого электрона можно описать как набор из трех квантовых чисел:
- Главное число
 - описывает уровень энергии.
- описывает уровень энергии. - Азимутальное число (l) - насколько быстро электрон движется по своей орбите (угловой момент); например, как быстро вращается компакт-диск (об / мин). Это связано с формой орбиты.
- Магнитный (м) - его ориентация в пространстве.
Орбитали имели разную форму и максимальное количество на любом уровне:
- s (острый) - сферический (max = 1)
- p (primary) - в форме гантели (max = 3)
- d (диффузный) - четырехлепестковый (max = 5)
- f (основная) - шестилепестковая (макс = 7)
Однако есть некоторые совпадения (подробности есть в любом учебнике химии).
Полученная модель атома называется квантовой моделью атома.
Натрий имеет 11 электронов, распределенных по следующим энергетическим уровням:
- одна s орбиталь - два электрона
- одна s-орбиталь - два электрона и три p-орбитали (по два электрона каждая)
- одна с орбиталь - один электрон

Современная периодическая таблица элементов (элементы упорядочены по атомному номеру, а не по массе).
- Химия: Периодическая таблица - рисунок и расположение таблицы отражает расположение электронов в атоме. Элементы имеют разные атомные номера - количество протонов или электронов увеличивается вверх по таблице по мере того, как электроны заполняют оболочки. У элементов разные атомные массы - количество протонов плюс нейтроны увеличивается вверх по таблице. Строки - элементы каждой строки имеют одинаковое количество энергетических уровней (оболочек). Столбцы - элементы имеют одинаковое количество электронов на внешнем энергетическом уровне или оболочке (от одного до восьми). Химические реакции- обмен электронами между различными атомами (отдача, взятие или обмен). Обмен вовлекает электроны на внешнем энергетическом уровне в попытки заполнить внешнюю оболочку (то есть наиболее стабильную форму атома).
- Физика Радиоактивность - изменения в ядре (т.е. распад) испускают радиоактивные частицы. Ядерные реакторы - расщепление ядра (деление). Ядерные бомбы - расщепление ядра (деление) или образование ядра (слияние). Атомные спектры - вызванные изменением уровней энергии возбужденных электронов (поглощение или испускание энергии в виде световых фотонов).
Можем ли мы увидеть атомы?

СТМ-изображение (7 нм x 7 нм) одной зигзагообразной цепочки атомов цезия (красный) на поверхности арсенсида галлия (синий).
Атомы настолько малы, что мы не можем видеть их нашими глазами (т.е. микроскопическими). Чтобы вы почувствовали некоторые размеры, это примерные диаметры различных атомов и частиц:
- атом = 1 х 10-10 метров
- ядро = от 1 x 10-15 до 1 x 10-14 метров
- нейтрон или протон = 1 x 10-15 метров
- электрон - точно не известно, но предполагается, что его размер составляет порядка 1 x 10-18 метров
Вы не можете увидеть атом в световой микроскоп. Однако в 1981 году был разработан тип микроскопа, названный сканирующим туннельным микроскопом (СТМ). STM состоит из следующего:
- Очень маленький острый наконечник, проводящий электричество (зонд)
- Устройство быстрого пьезоэлектрического сканирования, к которому крепится наконечник
- Электронные компоненты для подачи тока на наконечник, управления сканером и приема сигналов от датчика движения
- Компьютер для управления системой и анализа данных (сбор, обработка, отображение данных)
STM работает так:
- Ток подается на зонд (зонд), в то время как сканер быстро перемещает зонд по поверхности проводящего образца.
- Когда острие встречает атом, поток электронов между атомом и острием изменяется.
- Компьютер регистрирует изменение тока с помощью x, y-положения атома.
- Сканер продолжает позиционировать иглу над каждой точкой x, y на поверхности образца, регистрируя ток для каждой точки.
- Компьютер собирает данные и строит карту тока по поверхности, которая соответствует карте расположения атомов.
СТМ и новые варианты этого микроскопа позволяют нам видеть атомы. Кроме того, STM можно использовать для управления атомами, как показано здесь:

Атомы можно размещать на поверхности с помощью наконечника STM, создавая на поверхности индивидуальный узор.
Атомы можно перемещать и формовать для создания различных устройств, таких как молекулярные двигатели (подробности см. в теме «Как будут работать нанотехнологии»).
Таким образом, наука 20-го века раскрыла структуру атома. Ученые сейчас проводят эксперименты, чтобы выявить детали структуры ядра и сил, которые его удерживают.
